α-突触核蛋白特异性地定位于神经元的突触前末梢,并与突触前囊泡相关。它几乎不存在于细胞体、树突或突触外位点。该蛋白存在于周围神经系统 (PNS)、中枢神经系统 (CNS) 和红细胞中。
α-突触核蛋白通常是一种胞浆蛋白(内源性),然而,在人体体液如脑脊液 (CSF) 和血浆中可以发现少量的胞外 (外源性) 蛋白。Theillet等人(2016) 发现外源性 α-突触核蛋白是 N 端乙酰化的、无序的、动态的,并与细胞质相互作用在细胞内形成致密的结构。胞吐作用会自然分泌少量的单体和聚集体蛋白,然而,在细胞应激和线粒体功能障碍下的神经元细胞会向其外部环境释放高水平的内源性 α-突触核蛋白。调节细胞释放的内源性 α-突触核蛋白水平的内部机制基于神经元活动,并与谷氨酸能神经传递特别相关。这意味着谷氨酸激活突触后受体并提高突触血管胞吐释放的α-突触核蛋白的水平。
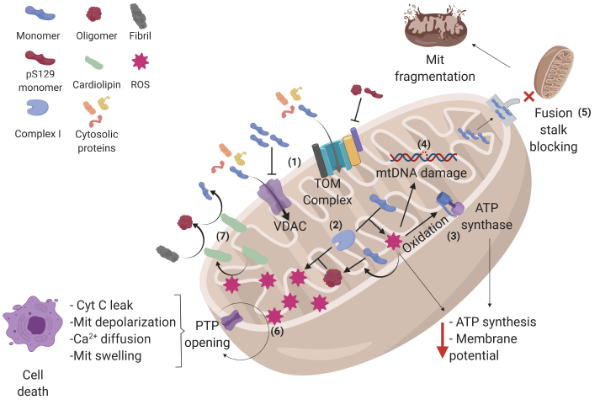
α-突触核蛋白的构象及其在线粒体中的相互作用。
(1)α-突触核蛋白(α-syn)单体通过外膜转位酶(TOM)和电压依赖性阴离子通道(VDAC)进入线粒体(Mit),但 TOM 上的寡聚体和 pS129-α-syn 以及 VDAC 上的 α-syn 积累会抑制蛋白质进入线粒体,从而影响依赖于胞浆蛋白的过程。
(2)一旦进入线粒体,α-syn 可以与电子传递链的复合物 I 相互作用,增加线粒体内活性氧(ROS)的产生,并有利于 α-syn 单体聚集成寡聚体,从而产生更多的 ROS,形成 α-syn 聚集和 ROS 产生相互加剧的循环。
(3) 活性氧 (ROS) 的增加会氧化 ATP 合酶 β 亚基,降低线粒体 ATP 水平;
(4) 还会损伤线粒体 DNA (mtDNA),从而导致线粒体基因组编码基因的表达发生改变。
(5) α-突触核蛋白 (α-syn) 单体还会阻断线粒体融合柄,导致线粒体碎片化。
(6) 此外,α-突触核蛋白还会诱导通透性转换孔 (PTP) 的开放,导致细胞色素 C (cyt C) 泄漏、去极化、钙离子扩散和线粒体肿胀,最终导致细胞凋亡。
(7) 某些应激事件,例如活性氧 (ROS),会刺激心磷脂从内膜移位到外膜,在外膜上,它充当聚集性突触核蛋白的缓冲剂。
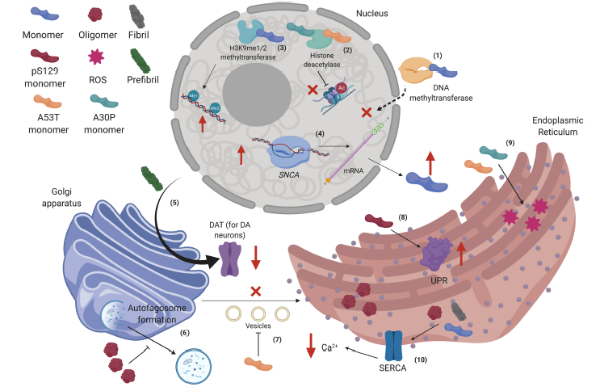
细胞核、高尔基体和内质网中的 α-突触核蛋白相互作用。
(1) 人类野生型 α-突触核蛋白 (hWT α-syn) 可将甲基转移酶保留在细胞质中,从而改变SNCA基因的 DNA 甲基化。
(2) hWT α-syn 还可以与 H3K9me1/2 相互作用,从而增加 DNA 中的单甲基化和二甲基化。(3) p.A53T 和 p.A30P 单体与 HDACS 结合并抑制组蛋白去乙酰化。
(4) SNCA基因表观遗传调控的降低促进了该基因的上调,从而增加了 α-syn 的转录并进一步积累。
(5) 前纤维 α-syn 可以破坏高尔基体 (GA) 中多巴胺转运体 (DAT) 的诱导后加工,从而减少其在膜中的存在。
(6) α-syn 寡聚体会抑制胃肠道 (GA) 中自噬体的形成。
(7) p.A53T 单体会抑制囊泡从内质网 (ER) 向胃肠道 (GA) 的运输。
(8) pS129-α-syn 单体会增强内质网中未折叠蛋白反应 (UPR) 的活性。
(9) p.A53T 和 p.A30P 单体会增加内质网中的应激水平。
(10) α-syn 寡聚体和原纤维会影响内质网中的 SERCA 复合物,从而降低胞浆中的 Ca 2+水平。
