重组tau蛋白的过表达和纯化
使用单体产品:
http://www.mabioway.com/aercihaimobing-ad-/14625.html
Cat. No. MAG-1190,Recombinant Tau-441 (2N4R) Wild-Type Monomers (MAG-1190)
Tau蛋白寡聚体制备方案1:
重组Tau蛋白寡聚化裂解缓冲液
1.500 毫升5M NaCl:在500毫升的最终体积中加入146.1克NaCl。
2.500 毫升1M Na2HPO4:在500毫升的最终体积中加入70.98克Na2HPO4 。
3.500 毫升1M NaH2PO4:在500毫升的最终体积中加入78克NaH2PO4 。
4.75 毫升1M Na3PO4缓冲液(pH 7.2):加入 51.3 毫升 1M Na2HPO4和23.7毫升1M NaH2PO4。
5.1.5L 低聚物透析缓冲液:加入 30 ml 5 M NaCl、75 ml 1 M NaPO4缓冲液(pH 7.2),并用 ddH2O加满。储存于4 °C。
6.30% H₂O₂ 。储存于4°C 。
7.抗tau蛋白一抗、蛋白质印迹试剂和设备。
重组Tau单体的寡聚化
1.向重组的tau单体蛋白中加入TCEP,使其最终浓度达到 0.287mg/ml。
2.加入EDTA至最终浓度为5mM。
3.在37°C下孵育1小时。
4.用超纯蒸馏水清洗20K MWCO蛋白质浓缩器,将洗脱液转移到柱中,并在4°C下以40,000×g离心,用寡聚化缓冲液进行缓冲液交换(将约5毫升与47毫升寡聚化缓冲液混合,并进行多次离心——每次持续 20分钟——直到收集到约50毫升流出液和1.5-2毫升浓缩液)。
5.收集滤液,加入30%H2O2,使最终浓度达到1mM。
6.在室温下持续旋转孵育20小时,以引入二硫键。
7.再次用寡聚化缓冲液透析,(清洗蛋白浓缩器后,将上一步的洗脱液与寡聚化缓冲液混合,并进行多次离心。我们希望收集 50 ml 流出液和 1-2 ml 柱上样品。调整最终从柱上收集的体积可能会导致样品浓度更高或更低。但是,我们不建议收集少于 1 ml 的体积,因为在最后一步很难预测通过过滤器的体积,这可能会导致蛋白质损失。)。
8.使用nanodrop分光光度计测定 280 nm 处的吸光度来确定 tau蛋白浓度(使用 45,900 kDa 的分子量和 7450 cm−1m −1的消光系数。空白测量使用寡聚化缓冲液。),并通过Western Blot可视化 tau寡聚体(图 3)(为了进行Western Blot可视化,将7μg样品与不含还原剂的上样缓冲液混合,并在100 °C下煮沸5分钟。之所以不添加还原剂,是因为还原剂会破坏二硫键,导致我们只能观察到单体而无法观察到由二硫键形成的高阶寡聚体。按照常规Western Blot流程,将样品上样至10% Tris-乙酸凝胶,然后转移至硝酸纤维素膜上。免疫印迹实验中,我们使用了根据制造商说明稀释至最终浓度的抗tau抗体。显色后,您应该能够检测到分子量大于100 kDa的条带,这些条带代表tau寡聚体,分子量约为50 kDa的条带代表单体形式)。
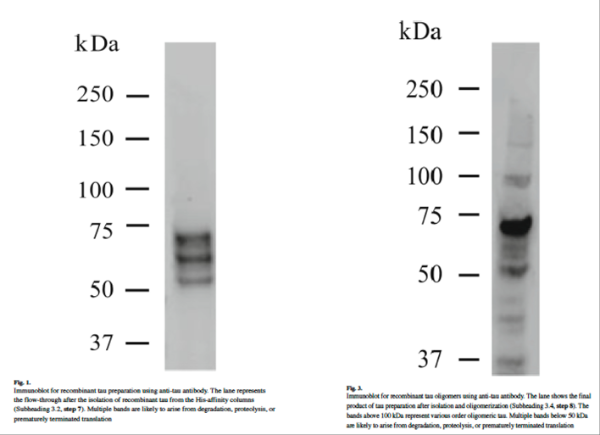
Tau蛋白寡聚体制备方案2:
将重组tau蛋白(Cat. No. MAG-1190,Recombinant Tau-441 (2N4R) Wild-Type Monomers)tau-441(2N4R) 45.9 kDa;用8M尿素处理以获得单体tau蛋白,然后在pH 7.4的1×PBS缓冲液中透析过夜。用PBS将样品浓度调整至1 mg/ml,并将tau单体(溶于PBS)分装后保存于-20°C。将300 μl tau蛋白原液(1 mg/ml)与700 μl 1×PBS混合,得到tau寡聚体,最终浓度为0.3 mg/ml。然后将样品在室温下于轨道摇床上孵育 1 小时(Lasagna-Reeves 等,2010;Lasagna-Reeves 等,2011c)。所得 tau 寡聚体通过快速蛋白液相色谱法(Superdex 200柱;GE Healthcare)纯化。
TOMA 特异性识别 tau 寡聚体
利用源自全长人tau蛋白的tau寡聚体开发了TOMA抗体,其方法与之前报道的多克隆抗tau寡聚体抗体(T22)的制备方法相同(Lasagna-Reeves等,2012a)。通过Western blot、ELISA和斑点印迹分析(图1)证实了该抗体的特异性,结果表明,该新型抗体主要识别tau蛋白的二聚体和三聚体,而不与单体tau蛋白或其他淀粉样蛋白的寡聚体发生反应,例如6E10识别的Aβ或4D6识别的α-突触核蛋白(图1 A–D)。TOMA是一种IgG2a抗体,对tau寡聚体具有高亲和力(解离常数Kd= 3.1 × 10-7),该亲和力通过ELISA稀释法测定。通过使用 AD 人脑匀浆的蛋白质印迹法也证实了该抗体对 tau 寡聚体的特异性。
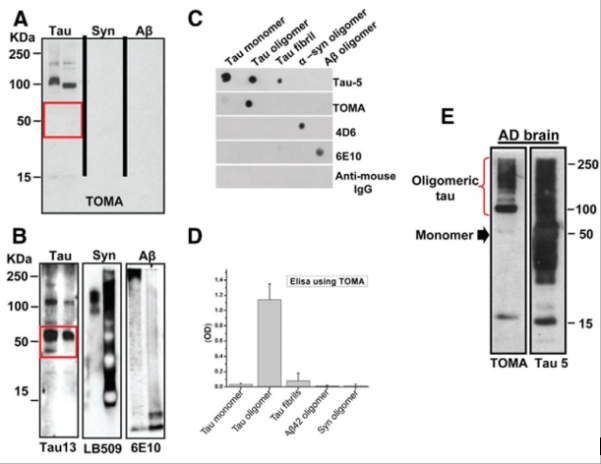
TOMA抗体的特异性。A ,体外形成的tau蛋白、α-突触核蛋白和Aβ聚集体(每泳道2 μg蛋白)的Western blot分析,使用TOMA抗体进行检测。B ,使用与A相同的膜,用序列特异性抗体进行复染。TOMA特异性识别tau寡聚体,但不识别其他淀粉样蛋白的寡聚体或单体tau蛋白(红色方框)。C ,重组tau单体、寡聚体和原纤维;重组α-突触核蛋白;以及Aβ42寡聚体的代表性斑点印迹分析,分别使用Tau-5、TOMA、4D6、6E10和抗小鼠IgG进行检测。D , ELISA分析证实TOMA对单体tau蛋白没有反应性,对体外制备的tau原纤维(50 ng/孔)也没有显著的反应性。即使在灵敏度较高的ELISA分析中,TOMA也无法识别其他淀粉样蛋白(如Aβ或α-突触核蛋白)的寡聚体。E图显示了使用TOMA(tau寡聚体特异性抗体)和Tau-5(可识别所有形式的tau蛋白)对AD脑组织PBS可溶性组分进行Western blot分析的结果。TOMA特异性地检测到了对应于tau寡聚体的条带(红色括号),但无法识别AD脑组织中含量丰富的单体tau蛋白(黑色箭头),这由Tau-5的免疫反应性所证实(每泳道25 μg蛋白)。
Tau蛋白寡聚体制备方案3:
Aβ低聚物的制备
将1 mg冻干的Aβ42肽溶于1.5 mL 50%乙腈溶液(乙腈:水)中,分成三份,每份500 μL(约0.3 mg),再次干燥。取每管0.3 mg肽溶于200 μL六氟异丙醇(HFIP)中,室温孵育10-20分钟。向该溶液中加入700 μL双蒸水。用带孔盖密封试管,使HFIP挥发。然后在通风橱中,用涂有聚四氟乙烯的微型搅拌子以500 rpm的转速搅拌36小时。
重组tau寡聚体的制备
重组全长人tau蛋白(tau 441,2N4R,45.9 kDa)在大肠杆菌系统中表达,并按照先前描述的方法从该系统中纯化。然后,按照我们已发表的方案将该重组tau蛋白寡聚化。简而言之,用8M尿素处理tau蛋白以获得单体。将等分试样储存于-20°C。然后将单体tau蛋白透析至1×PBS缓冲液中,并通过添加1×PBS缓冲液调整最终体积,使tau蛋白的最终浓度为0.3 mg/mL。向其中加入稀释度为1:140 (w/w)的Aβ42寡聚体作为种子,并将样品在室温下于摇床上孵育1小时。该寡聚体制备物通过快速蛋白液相色谱(FPLC)纯化,并用于制备另一批新鲜的单体tau蛋白。为了排除任何残留的Aβ42寡聚体种子,对另一批(第三次)寡聚体制备物重复了上述步骤。经过三轮tau寡聚体制备后,最终样品中未检测到任何Aβ42寡聚体(种子),因为Aβ42 / tau比值估计小于1:2470000。该最终的tau寡聚体制备物用于生成标准曲线,并作为所有脑脊液样本ELISA检测的阳性对照。
