帕金森病 (PD) 是一种常见的慢性神经退行性疾病,其特征是黑质和其他脑区多巴胺能神经元的进行性丢失。α-突触核蛋白 (α-syn) 聚集到路易体和神经突中是与 PD 及其进展相关的关键病理特征。许多治疗研究旨在靶向这些聚集形式的 α-syn,以潜在地减缓或阻止 PD 的疾病进展。
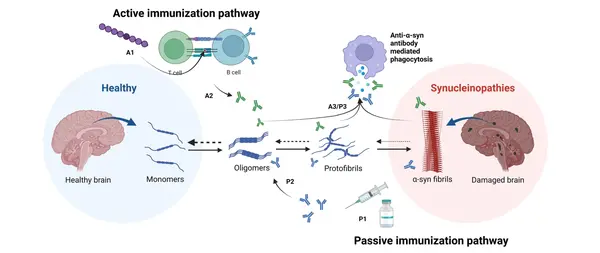
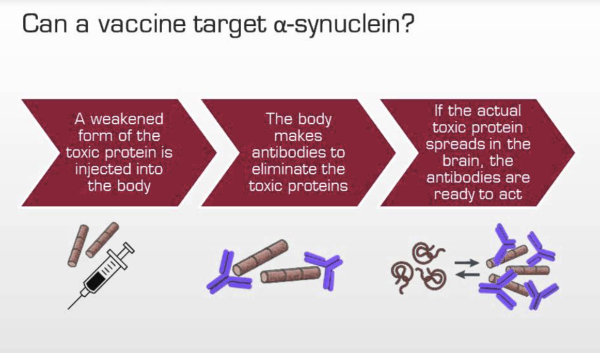
涉及靶向 α-syn 的疫苗和单克隆抗体的临床试验进行了全面分析。其中UB-312、AFFITOPE PD01A、PD03A和 ACI-7104.056 旨在激发针对 α-syn 的免疫反应(主动免疫),而 Prasinezumab、Cinpanemab、MEDI1341 和 Lu AF82422 则专注于直接靶向 α-syn 聚集体(被动免疫)。
帕金森病的病理特征是细胞内包涵体的积聚,这些包涵体被称为路易体 (LB) 和路易体神经突 (LN),由错误折叠的 α-突触核蛋白 (α-syn) 组成。在帕金森病中,α-syn 错误折叠和聚集,导致这些包涵体的形成,最初会破坏神经元功能。尽管帕金森病的发病机制尚未完全阐明,但显然 α-syn 起着关键作用。这种关联最初是在 1997 年发现一例家族性常染色体显性帕金森病的SNCA基因突变后提出的。随后,α-syn 被认为是 LB 和 LN 的主要成分之一,表明它们参与了帕金森病的发病机制。重要的是,α-syn 聚集还与相关的神经退行性疾病有关,例如路易体痴呆 (DLB) 和多系统萎缩 (MSA)。此外,人们不仅对 α-syn 在 PD 中的这种细胞自主功能感兴趣,而且对 α-syn 可以在神经网络中扩散并以类似朊病毒的方式引起疾病的非细胞自主过程也感兴趣。所有这些都意味着 α-syn 已成为 PD 的主要治疗靶点,其中一个目标是通过免疫方法阻止病理形式的 α-syn 的产生和扩散,从而减缓病情发展。
目前试验中的进展(表 1)。
针对α-突触核蛋白的免疫疗法
UB-312
UB-312 是由 Vaxxinity 公司开发的一种合成肽疫苗,靶向不溶性 α-syn 蛋白。该活性疫苗可产生针对 α-syn 97–135 C 末端表位的强效且时间依赖性的血清抗体,其滴度在第 29 周达到峰值,并在第 45 周保持在基线值以上。
AFFITOPE(PD01A、PD03A)和 ACI-7104.056
AFFITOPE PD01A (AFF008) 和 AFFITOPE PD03A (AFF011) 是由 AFFiRiS 公司开发的肽类疫苗。这些活性疫苗旨在产生针对 α-突触核蛋白寡聚体的免疫反应,从而减少其在脑中的聚集和扩散,且不引发任何有害的神经炎症反应。PD01A 使用一种经过修饰的八个氨基酸肽来模拟 α-突触核蛋白的 C 末端氨基酸。
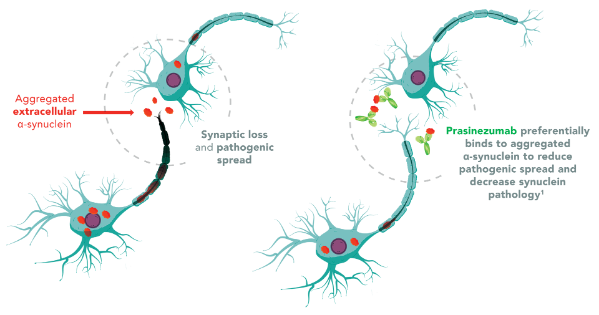
普拉西珠单抗
Prasinezumab 是一种靶向聚集 α-突触核蛋白的人源化 IgG1 单克隆抗体,由 Prothena 与罗氏公司合作开发。临床前研究表明,Prasinezumab 可减少具有神经毒性的截短型 α-突触核蛋白,并阻止 α-突触核蛋白在细胞间增殖,从而降低神经病理学并改善行为结果。
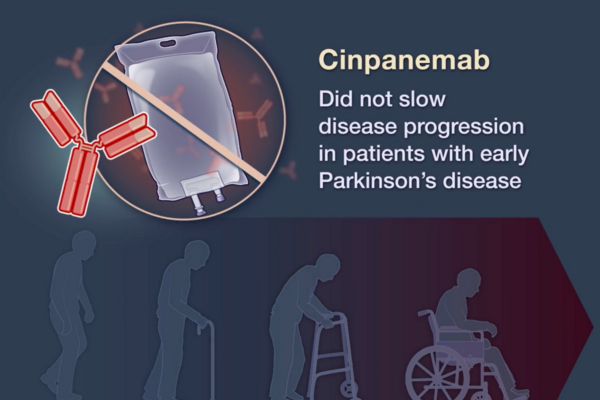
辛帕尼单抗
Cinpanemab (BIIB054) 是由百健公司 (Biogen) 开发的一种单克隆抗体,靶向 α-突触核蛋白 (α-syn),与 N 端 1-10 位残基结合,对聚集体 α-突触核蛋白的亲和力比单体 α-突触核蛋白高 800 倍。临床前研究表明,Cinpanemab 在细胞实验中可抑制 α-突触核蛋白的扩散,并在小鼠模型中减轻病理和运动障碍。
MEDI1341
MEDI1341 (TAK-341) 是一种高亲和力单克隆抗体,靶向α-突触核蛋白单体和聚集体上的C末端表位,最初由阿斯利康公司开发。临床前研究表明,MEDI1341静脉注射后可穿透动物脑部,有效降低脑脊液和脑间质液 (ISF) 中游离的细胞外α-突触核蛋白水平。该抗体在细胞培养和小鼠模型中被证明可阻止人α-突触核蛋白预形成纤维 (PFF) 的细胞间传播。在小鼠脑内α-突触核蛋白病理模型中,该抗体显著减少了α-突触核蛋白沿轴突的积聚和增殖。
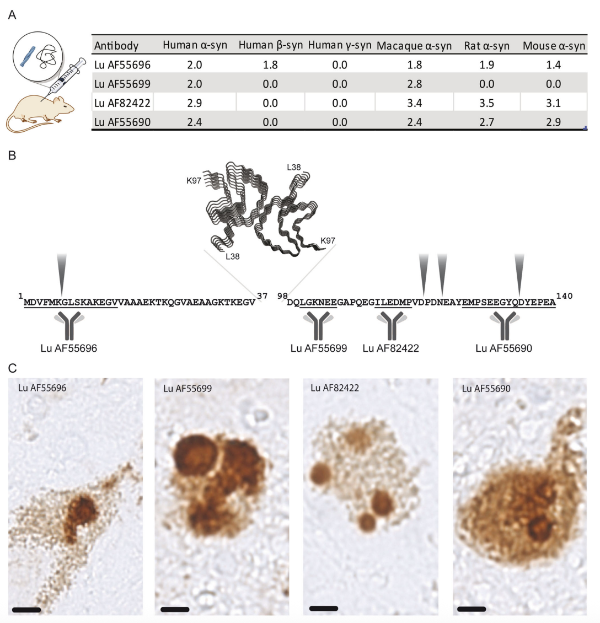
Lu AF82422
Lu AF82422 是由 Lundbeck A/S 公司开发的人源化单克隆 IgG1 抗体,靶向 α-突触核糖体 (α-syn) 的 C 末端。临床前研究已证明其在动物模型中的安全性和脑脊液靶向结合能力。流式细胞术分析表明,Lu AF82422 不与人血小板、红细胞、粒细胞或淋巴细胞的细胞外表面结合。然而,它确实与一小部分单核细胞结合,且不影响其活化或吞噬功能。
以 α-syn 为靶点仍然是 PD 疗法研发的一大重点。主动和被动免疫疗法均已被研究用于减少 α-syn 聚集体。UB-312、AFFITOPE PD01A、PD03A 和 ACI-7104.056 等主动免疫疗法旨在激发针对 α-syn 的免疫反应。同时,Prasinezumab、Cinpanemab、MEDI1341 和 Lu AF82422 等被动免疫疗法则直接以 α-syn 聚集体为靶点。UB-312 等主动免疫疗法可显著减少患者脑脊液中的 α-syn 种子。
理论上,有几种不同的情况可以将 α-syn 病理改变作为治疗性抗体的靶点。首先,由于 LB 和 LN 病理改变的胞浆性质,抗体可以进入细胞内空间直接中和 α-syn 的病理形式,例如寡聚体或原纤维。中和这些毒性物质可以降低其诱导细胞功能障碍和促进神经退行性变的能力。这些抗体的存在还可能干扰聚集动力学或促进细胞蛋白稳态反应。然而,由于细胞膜和潜在的血脑屏障的屏障功能,抗体有效渗透到细胞内空间具有挑战性,具体取决于给药途径,尽管该领域的技术正在迅速发展。其次,释放到细胞外空间(例如间质液或突触间隙)的 α-syn 可能是治疗性抗体更易处理的靶点。有大量实验证据描述了 α-syn 的细胞间传播及其如何促进 α-突触核蛋白病的进展。然而,没有证据表明抗体能够有效进入突触间隙或穿透细胞外囊泡(如外泌体)的膜来靶向释放的 α-syn。游离 α-syn 可能成为抗体更合理的细胞外靶点。最近的证据表明,局部复制(而不是大脑区域之间的扩散)可能是驱动 Tau 聚集体从阿尔茨海默病 (AD) Braak III 期及以后积累的主要机制。这是否也适用于 α-syn 聚集还有待确定。最后,与最初为支持抗淀粉样蛋白 β 抗体的治疗作用而提出的外周接收器假说类似,中和脑脊液或血液中 α-syn 的抗体也可能降低脑组织中的 α-syn 浓度。然而,这种假设建立在脑内外α-突触核蛋白处于平衡状态的假设之上。如果是这样,脑脊液或血液中α-突触核蛋白的去除,加上浓度梯度的被动扩散,就会导致脑内α-突触核蛋白的减少。
