介绍:
小分子 pull-down 则是在 pull-down 的基础上,通过化学合成的方法将活性小分子进行修饰,连接上报告分子(如生物素),制备成小分子探针,通过探针分子上的报告分子(生物素)将其固定在与其亲和的固相支持物(如磁珠)上充当诱饵,与蛋白样品或细胞/组织裂解液共孵育,可捕获样品中与诱饵小分子互作的蛋白,接着通过洗涤或洗脱过程去除杂质,并将捕获的蛋白回收,进行 WB 检测分析或质谱鉴定。
蛋白-小分子互作在药物开发中扮演着至关重要的角色,它们是药物作用机制的核心。随着药物化学和分子生物学的发展,研究小分子药物与蛋白质相互作用的实验技术日益增多,为药物设计、药物筛选和药物作用机制的理解提供了强有力的工具。

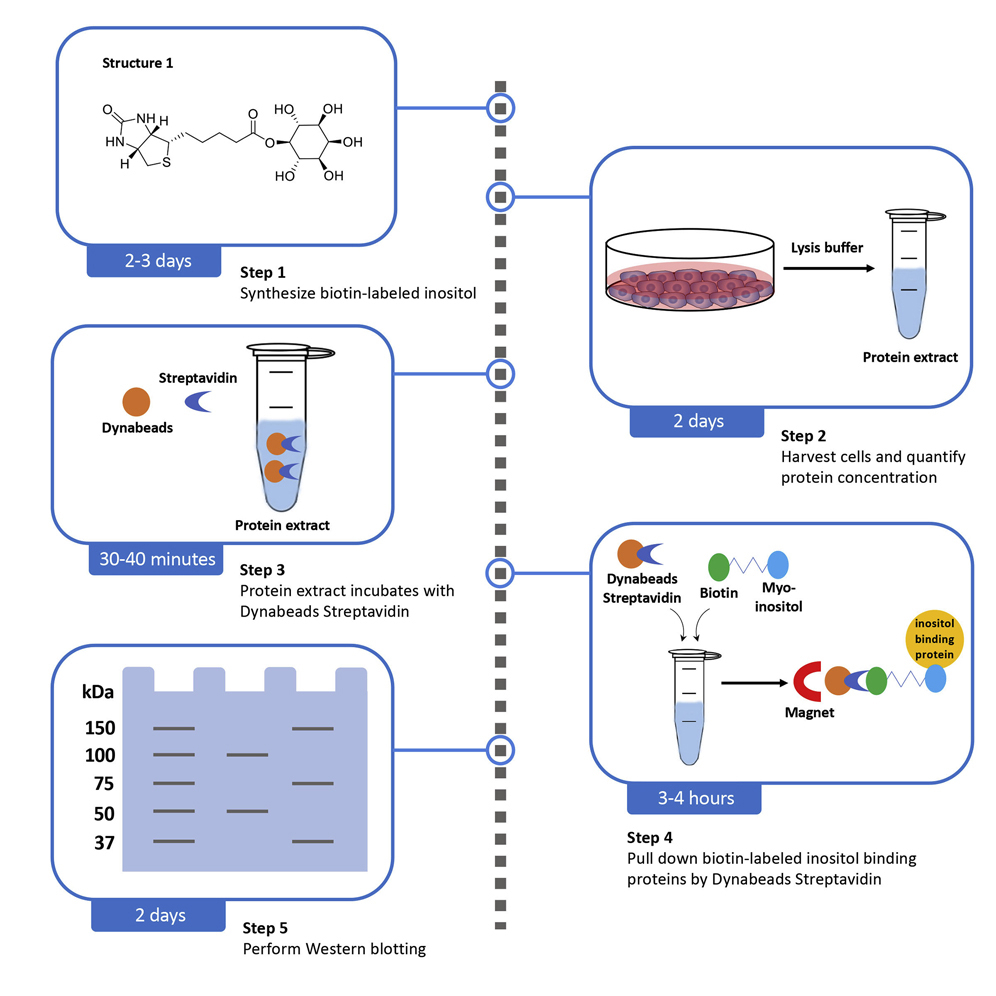
图1 小分子 pull-down 基本实验流程图
实验流程:
1. 探针制备:活性小分子标记以及标记后的小分子活性鉴定。
2. 探针固定:探针分子固定在固相支持物上,如生物素标记的小分子可固定在链霉(亲和素)磁珠上。
3. 磁珠与蛋白样品孵育,并洗去杂蛋白。
4. 洗脱目的蛋白并进行 WB 检测或 SDS-PAGE 检测后进行质谱鉴定。
分类:
直接小分子 pull - down:通过生物素将小分子固定在磁珠上,与蛋白样品孵育后,直接捕获与小分子互作的蛋白,该方法不适用于瞬时结合、瞬时解离的小分子。
光交联法小分子 pull - down:先对药物小分子进行修饰,使其携带光交联基团,与细胞总蛋白孵育后,进行 UV 照射使小分子与靶蛋白共价连接,随后通过点击化学反应使小分子生物素化,再通过链霉亲和素磁珠对捕获的蛋白进行富集、洗涤、回收和检测。
邻近标记交联法小分子 pull - down:使用生物素化的小分子,在孵育过程中使用改造后的链霉亲和素磁珠,能通过特殊的酶催化反应,使小分子钓取到的靶蛋白与链霉亲和素之间产生共价连接,随后通过洗涤步骤洗去杂质,并回收得到的蛋白进行检测。
优势:
1. 相对于蛋白质芯片技术、小分子靶向蛋白分子显像技术、蛋白(多肽)展示文库筛选技术等,小分子 pull - down 实验操作简单,周期短,成本低廉。
2. 小分子与蛋白大多数为共价结合,特异性较强,结合紧密,实验结果复现率高,下游验证结合阳性概率较大。
3. 液质联用技术灵敏度可达pg级别,极其微量的蛋白能被分析出来。
参考文献:
1. Hsu CC, Xu ZG, Lei J, Chen ZZ, Li HY, Lin HK. Identification of myo-inositol-binding proteins by using the biotin pull-down strategy in cultured cells. STAR Protoc. 2022 May 14;3(2):101385. doi: 10.1016/j.xpro.2022.101385. PMID: 35600928; PMCID: PMC9117919.
2. Ma T, Tian X, Zhang BD, et al. Low-dose metformin targets the lysosome-AMPK pathway through PEN2. Nature 2022.